Cribado virtual de Análogos de Osimertinib y Dacomitinib con actividad potencial sobre el receptor de factor de crecimiento epidérmico EGFR (MUTACIONES T790M Y L858R) para el tratamiento del cáncer de pulmón no microcítico
Virtual screening of Osimertinib and Dacomitinib Analogues with potential activity on EGFR (T790M and l858R Mutations) for non-small cell lung cancer treatment
Contenido principal del artículo
Resumen
Introducción: Los fármacos inhibidores de la tirosina quinasa (TKI) actúan sobre receptores del factor de crecimiento epidérmico (EGFR) para tratar el cáncer de pulmón no microcítico (CPNM). Sin embargo, las mutaciones del EGFR T790M y L858R sólo permiten una tasa de respuesta global (GRR) del 80% con Osimertinib, mientras que Erlotinib y Gefitinib sólo 10%.
Objetivo: Identificar moléculas prometedoras análogas a los fármacos inhibidores de la tirosina quinasa (TKIs) con capacidad potencial de unirse al EGFR nativo y mutado (T790M y L858R) para evitar la resistencia mutacional en el CPNM.
Métodos: Se realizó un cribado virtual mediante acoplamiento molecular entre análogos de Osimertinib (DB09330) y Dacomitinib (DB11963) obtenidos de la base de datos DRUGBANK y receptores de EGFR nativos y mutados (L585R y T790M) obtenidos del Protein Data Bank, para esto se utilizó el software PyRx. Por último, se realizó predicción toxicológica utilizando GUSTAR.
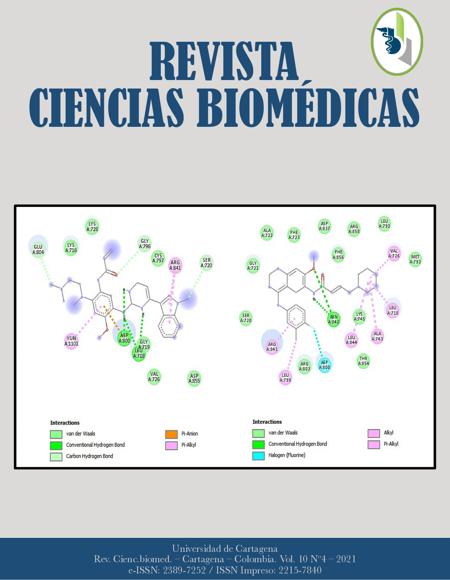
Resultados: Los análogos DB03878, DB04739, DB07280 y DB06876 alcanzaron una afinidad significativa (-9,1 y -8,3 Kcal/mol) sobre el EGFR mutado T790M en comparación con osimertinib (-7,6 Kcal/mol). Del mismo modo, DB08091, DB08730, DB07220 y DB06920 alcanzaron una afinidad significativa (entre 9,4 y -8,9 Kcal/mol) sobre el EGFR mutado L858R en comparación con dacomitinib (-7,0 Kcal/mol). En general, las fuerzas de Van der Waals y de los enlaces π-alquilo perdominaron. Además, DB08730 y DB03878 fueron seguros con categoría IV según las predicciones toxicológicas.
Conclusión: Ocho análogos de TKI mostraron una energía de unión superior sobre el EGFR en comparación con los fármacos de referencia. De acuerdo con las predicciones toxicológicas, sólo 2 análogos fueron seleccionados como candidatos seguros de tipo TKI prometedores para el tratamiento del CPNM resistente.
Palabras clave:
Descargas
Detalles del artículo
Referencias (VER)
Campos-parra AD, Cruz-rico G, Arrieta O. Genotipificación en cáncer de pulmón de células no pequeñas. Gac Mex Oncol. 2012;1(22):35–44.
Remon J, Caramella C, Jovelet C, Lacroix L, Lawson A, Smalley S, et al. Osimertinib benefit in EGFR-mutant NSCLC patients with T790M-mutation detected by circulating tumour DNA. Ann Oncol. 2017;28(4):784–90.
Contreras-Puentes N, Mercado-Camargo J, Alvíz-Amador A. In silico study of ginsenoside analogues as possible BACE1 inhibitors involved in Alzheimer’s disease. F1000Research. 2019;8:1169.
Trott O, Olson AJ. Software News and Update AutoDock Vina: Improving the Speed and Accuracy of Docking with a New Scoring Function, Efficient Optimization, and Multithreading. J Comput Chem. 2010;31(2):455–461.
Dassault Systemes BIOVIA. Discovery Studio Visualizer 4.5 (2016). 2016.
Fernández Molina JC, Pérez Pérez V. El receptor de EGF (EGFR): una diana terapéutica para el tratamiento den cáncer y sus inhibidores. España; 2006.
Hanan EJ, Baumgardner M, Bryan MC, Chen Y, Eigenbrot C, Fan P, et al. 4-Aminoindazolyl-dihydrofuro[3,4- d]pyrimidines as non-covalent inhibitors of mutant epidermal growth factor receptor tyrosine kinase. Bioorganic Med Chem Lett. 2016;26(2):534–9.
Hanan EJ, Eigenbrot C, Bryan MC, Burdick DJ, Chan BK, Chen Y, et al. Discovery of selective and noncovalent diaminopyrimidine-based inhibitors of epidermal growth factor receptor containing the T790M resistance mutation. J Med Chem. 2014;57(23):10176–91.
Reiersølmoen AC, Aarhus TI, Eckelta S, Nørsett KG, Sundby E, Hoff BH. Bioorganic Chemistry Potent and selective EGFR inhibitors based on 5-aryl-7 H - pyrrolopyrimidin-. Bioorg Chem. 2019;88:102918.
Tavakoli F, Ganjalikhany MR. Structure-based inhibitory peptide design targeting peptide-substrate binding site in EGFR tyrosine kinase. PLoS One. 2019;14(5):e0217031.
Lopez Reyes E. Sintesis de precursores para la preparación de acetileno-quinonas, modelos útiles para el estudio de la interacción no covalente del tipo pi/pi. Universidad nacional autónoma de México; 2010.
Gajiwala KS, Feng J, Ferre R, Ryan K, Brodsky O, Weinrich S, et al. Insights into the aberrant activity of mutant EGFR kinase domain and drug recognition. Structure. 2013;21(2):209–19.
European Medicines Agency. Assessment report - Vizimpro. 2019. p. 7–144.
Jänne PA, Boss DS, Camidge DR, Britten CD, Engelman JA, Garon EB, et al. Phase I Dose-escalation Study of the Pan-HER Inhibitor, PF299804, in Patients with Advanced Malignant Solid Tumors. Clin Cancer Res. 2011;17(5):1131–9.
Lavacchi D, Mazzoni F, Giaccone G. Clinical evaluation of dacomitinib for the treatment of metastatic non-small cell lung cancer (NSCLC): current perspectives. Drug Des Devel Ther. 2019;13:3187–98.
DongS,LiY,YangH,WuY,LiY,DingC,etal.An Accurate and Effective Method for Measuring Osimertinib by UPLC-TOF-MS and Its Pharmacokinetic Study in Rats. 2018;23(11):2894.
Vishwanathan K, So K, Thomas K, Bramley A, English S, Collier J. Absolute Bioavailability of Osimertinib in Healthy Adults. Clin Pharmacol Drug Dev. 2019;8(2):198–207.
Planchard D, Brown KH, Wan D, Sang K, Kim W, Ohe Y, et al. Osimertinib Western and Asian clinical pharmacokinetics in patients and healthy volunteers: implications for formulation, dose, and dosing frequency in pivotal clinical studies. Cancer Chemother Pharmacol. 2016;77(4):767–76.
Schiefer M, Hendriks LEL, Dinh T, Lalji U, Dingemans AC. ScienceDirect Current perspective : Osimertinib- induced QT prolongation : new drugs with new side-effects need careful patient monitoring. Eur J Cancer. 2018;91:92– 8.
Xu Z, Li J. Comparative review of drug – drug interactions with epidermal growth factor receptor tyrosine kinase inhibitors for the treatment of non-small-cell lung cancer. Onco Targets Ther. 2019;12:5467–84.
Macleod AK, Lin D, Huang JTJ, Mclaughlin LA, Henderson CJ, Wolf CR. Cancer Therapy: Preclinical Identification of Novel Pathways of Osimertinib Disposition and Potential Implications for the Outcome of Lung Cancer Therapy. Clin Cancer Res. 2018;24(9):2138–48.
Sepúlveda JM, Sánchez-gómez P, Ángeles M, Salgado V, Gargini R, Balañá C. Ac ce pt cr t. Expert Opin Investig Drugs. 2018;0(0):1.
Bello CL, Labadie RR, Ni G, Boutros T, Mccormick C, Ndongo MN. The effect of dacomitinib (PF-00299804) on CYP2D6 activity in healthy volunteers who are extensive or intermediate metabolizers. Cancer Chemother Pharmacol. 2012;69(4):991–7.
Garcia AR, Giri N, Labadie RR, Ni G, Boutros T, Richie N, et al. A Phase I Open ‐ Label Study to Investigate the Potential Drug – Drug Interaction Between Single ‐ Dose Dacomitinib and Steady ‐ State Paroxetine in Healthy Volunteers. J Clin Pharmacol. 2013;54(5):555–462.
Liam CK. Osimertinib as first-line treatment of EGFR mutant advanced nonsmall- cell lung cancer. Transl Lung Cancer Res. 2017;6(Suppl 1):S62–6.


 PDF
PDF
 FLIP
FLIP




